作为最具侵袭性和致死性的恶性肿瘤之一,胰腺癌的发病率较高,五年生存率较低(<8 %)。研究表明,超过90 %的胰腺癌病例显示出癌细胞的恶性增殖和细胞代谢的重编程,导致其对细胞凋亡产生抵抗性。随着对癌症治疗机制的研究逐渐深入,一些新型非凋亡细胞死亡形式(焦亡、自噬、铁死亡、铜死亡等)的出现,为胰腺癌的治疗提供了新的契机。
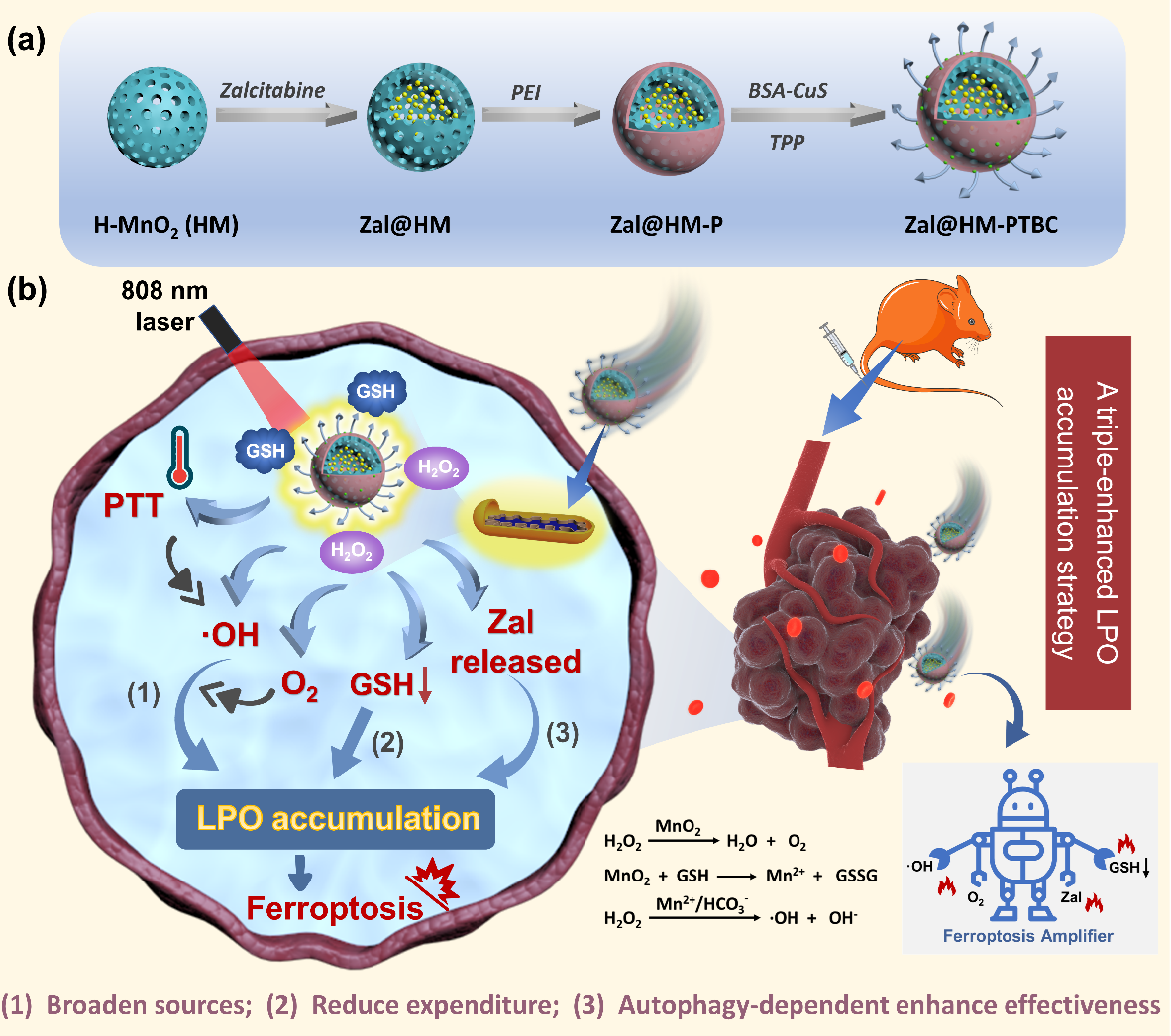
铁死亡是一种由过量脂质过氧化物(LPO)驱动的可调节细胞死亡方式。然而,缺氧和谷胱甘肽(GSH)高表达的肿瘤微环境(TME)不仅会抑制LPO的产生,而且会诱导谷胱甘肽过氧化物酶4(GPX4)介导的LPO清除作用,限制了铁死亡的肿瘤抑制作用。针对这一挑战,0638太阳集团石硕教授团队制备了一种基于三重增强LPO积累策略的铁死亡放大器(Zal@HM-PTBC),将之应用于胰腺癌的治疗,相关研究成果“A ferroptosis amplifier based on triple-enhanced lipid peroxides accumulation strategy for effective pancreatic cancer therapy”发表于国际知名期刊Biomaterials。

在这项研究中,研究人员通过硬模板法合成了具有中空结构的二氧化锰(HM)作为纳米核心,搭载药物扎心他滨(Zal)后,经进一步表面功能化,获得铁死亡放大器(Zal@HM-PTBC)。所合成的铁死亡放大器具有优异的TME响应降解性能,从而触发O2、Mn2+及Zal的释放。释放的Mn2+催化H2O2产生·OH,结合808 nm激光辅助的光热转换对Mn2+介导的类芬顿反应的加速作用,实现ROS扩增。相关实验表明升高的O2和ROS含量有助于协同促进LPO的生成(开源作用),同时Zal@HM-PTBC介导的GSH消耗削弱了GPX4的活性,导致LPO清除下降(节流作用),Zal的响应性释放促进了自噬依赖性LPO的积累(增强作用)。基于以上三重增强策略,Zal@HM-PTBC在体内外均表现出显著增强的铁死亡活性,结合光热治疗有效抑制了肿瘤的生长,为胰腺癌的治疗提供了可供借鉴的新思路。
石硕教授及太阳成集团附属东方医院梁淑静主治医师为本文的共同通讯作者,0638太阳集团博士生陈梦瑶和东方医院硕士生童小涵为共同第一作者。该研究工作得到了国家自然科学基金、上海市自然科学基金等项目的支持。
论文链接:https://doi.org/10.1016/j.biomaterials.2024.122574
