手性含膦化合物广泛存在于天然产物和药物活性分子中,同时也是重要的手性催化剂和配体,极大地促进了有机化学的发展,在不对称催化中扮演重要角色。近年来,随着金属催化的不断发展与深入,更加凸显手性配体在化学合成以及医药、材料、精细化工等领域中的重大作用。然而,手性含膦化合物的合成方法十分有限,多依赖于手性拆分等手段。而通过含膦化合物的不对称碳碳成键反应为合成手性含膦化合物提供了一条非常便利的途径。
公司徐涛教授课题组致力于膦化合物的不对称合成研究。近日,该课题组在光镍催化α-芳基磷酸酯化合物不对称合成方面取得重要进展,相关研究成果以Modular and Facile Access to Chiral α-Aryl Phosphates via Dual Nickel- and Photoredox-Catalyzed Reductive Cross-Coupling为题发表在国际化学领域最重要的学术期刊《美国化学会志》(Journal of the American Chemical Society)上。
碳碳键的不对称成键一直以来都是有机化学研究的重要领域,偶联反应因其精准成键成为重要方式之一。同时由于镍催化剂在sp3碳成键方面的巨大优势,被广泛应用于不对称碳碳偶联反应当中。目前已经发展了几种常见的研究策略。首先是传统的不对称偶联,以亲电试剂和亲核试剂为基础的成键反应。其次是不对称还原偶联策略,借助于金属还原剂如锌、锰等实现的两个亲电试剂的交叉偶联反应,不需要提前制备有机金属试剂,反应简捷。之后,借助于光镍体系,也实现了一些在该条件下的直接不对称偶联反应。
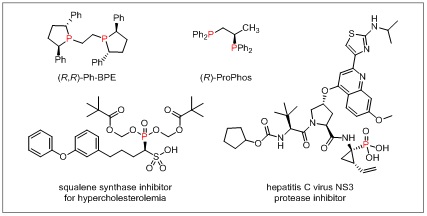
为了进一步实现高效、便利的不对称偶联反应,徐涛教授课题组将光镍催化体系应用于不对称还原偶联反应中,实现了一系列的成键反应,尤其是对于传统策略中无法实现的转化进行了重点研究,发展了多个光镍双催化不对称还原反应新类型。在之前的工作中,已经实现了硼酸酯、三氟甲基等结构的α-芳基化反应。为了进一步拓展该研究体系,该课题组报道了一种制备手性α-芳基磷酸酯的新方法。该反应在光镍双催化条件下,通过芳基碘化物和α-溴磷酸酯的不对称还原交叉偶联,以良好官能团耐受性和优异对映选择性合成得到手性α-芳基磷酸酯化合物,并将其应用于新型手性膦配体的开发和酶抑制剂类似物的合成当中。
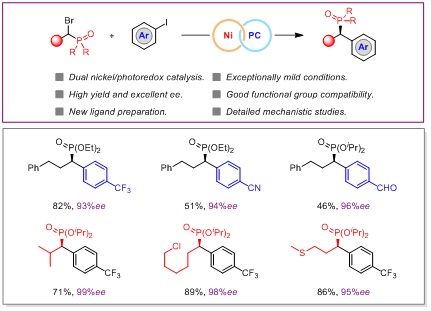
值得一提的是,该反应无论是传统的金属还原剂还是有机还原剂,都无法实现其顺利转化,这也说明了相比于传统策略,光镍催化不对称还原偶联反应体系的独特性。研究人员对反应机理也进行了深入研究,进一步阐明了该反应体系的优势,解释了之所以传统还原偶联条件不能进行的可能原因。中南大学的李玉强老师为该反应进行了DFT计算,对反应历程以及产物构型的决定步骤从理论上进行了论证。
公司博士研究生王贺盼为第一作者,徐涛教授为通讯作者。该项研究工作得到了国家自然科学基金、国家级青年人才计划等项目的资助。
论文链接:https://pubs.acs.org/doi/10.1021/jacs.1c12424
