石硕教授课题组跨学科合作研究在乳腺癌治疗方面取得重要进展 乳腺癌一直是世界范围内女性发病率居首位的恶性肿瘤,其中三阴乳腺癌(TNBC)复发转移率高,复发转移后生存期短,预后差,化疗容易耐药。目前TNBC的治疗手段主要为手术切除、化疗和放疗,无法进行雌孕激素受体拮抗剂和抗Her-2靶向治疗。因此,如何改善TNBC的治疗效果是现在临床乳腺癌治疗的难题。针对这一难题,公司石硕教授课题组联合太阳成集团附属东方医院乳腺肿瘤科主任董春燕教授课题组开展跨学科合作研究,提出了一种化疗联合免疫治疗协同光热和光动力技术治疗TNBC的新策略。日前,相关研究成果发表于国际知名期刊Advanced Materials上(IF: 25.8)。 近些年来,随着Ipilimumab和Nivolumna的上市,免疫治疗通过激活失调或者耗竭的细胞毒性T细胞(CTLs)来识别杀伤肿瘤细胞在肿瘤治疗领域取得了革命性的成果。虽然免疫治疗在黑色素瘤和非小细胞肺癌(NSCLCs)取得了很好的效果,但是在乳腺癌治疗上效果却不那么显著,CTLs浸润的少和骨髓源抑制性细胞(MDSCs)负荷多是主要因素之一。MDSCs可以减少T细胞的增殖促进CD8+T细胞的凋亡,最终导致免疫抑制。MDSCs分为两种类型,M1型和M2型,其中M1型可以分泌IL-12和TNF-α来杀伤肿瘤细胞,而M2型就是通常说的肿瘤相关巨噬细胞,它分泌IL-10、IL-4和IL-13来促进肿瘤血管的生成。 传统观点认为化疗能抑制免疫系统,但最新的研究表明低剂量的化疗药可促进肿瘤免疫原性死亡或参与肿瘤特异性的免疫反应,如多西他赛(DTX)可以促进MDSCs的M2亚型向M1亚型转化。CpG,作为免疫佐剂,可以特异性识别浆细胞样抗原提呈细胞表面的Toll样受体9,进而刺激1型T细胞辅助细胞(Th1)产生炎症前因子(比如TNF-α、IL-12)。而IL-12作为最有效的刺激物可以促使大量的CTLs浸润到肿瘤部位,同时激活的CTLs分泌IFN-γ来杀死肿瘤细胞。 为此,公司石硕教授和董春燕教授课题组开展跨学科合作研究,积极尝试通过化疗联合免疫治疗TNBC。研究人员将介孔硫化铜(CuS)作为药物载体负载低剂量的多西他赛,发挥其良好的光热转换效率提供光热治疗。利用肿瘤主动靶向受体叶酸(FA),使纳米粒有效地靶向定位肿瘤病灶。同时,为了提高纳米粒的水溶性和实现CpG的负载,研究人员利用聚乙烯亚胺-原卟啉 IX(PEI-PpIX)包覆于CuS表面,有助于CpG吸附于纳米粒表面并实现光动力治疗,最终构建了FA-CuS/DTX@PEI-PpIX-CpG (FA-CD@PP-CpG)多功能纳米抗肿瘤药物复合体。FA-CD@PP-CpG通过静脉注射后可靶向定位到肿瘤部位,负载的DTX和CpG释放出来,DTX促进MDSCs中的M2亚型向M1亚型转化并分泌出IL-12、TNF-α因子,而CpG则识别抗原提呈细胞,促使Th1细胞产生IL-12、TNF-α,增多的IL-12可以促使T细胞浸润至肿瘤部位,并激活形成CTLs激活的CTLs可以分泌IFN-γ杀死肿瘤细胞,在T细胞浸润至肿瘤部位后通过皮下注射PD-L1抗体(aPD-L1)进一步增强免疫治疗的效果从而达到全身治疗的目的。这是一个具备光热和光动力治疗功能的化疗协同免疫治疗,局部治疗结合全身治疗的新策略。 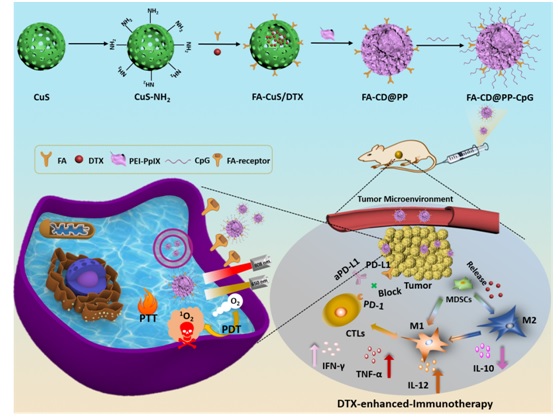
公司直博生周露露和硕士生陈律为该论文的共同第一作者,公司石硕教授和太阳成集团附属东方医院董春燕教授为该论文的共同通讯作者。 论文链接:https://onlinelibrary.wiley.com/doi/full/10.1002/adma.201904997 |
